pcdm10 pcdm10是什么处理器

导读

多发性瘤(MM),作为一种血液系统的恶性肿瘤,主要由浆细胞异常增生并产生过量的单克隆免疫球蛋白或轻链(即M蛋白)所致。这种疾病常常引发免疫系统功能异常,表现为多发性溶骨性损害、高钙血症、贫血和肾损害等症状。尽管目前对多发性瘤尚无法实现根治,但自体干细胞移植及新型药物如蛋白酶体抑制剂、来那度胺、伊沙佐米,或最近在中国上市的daratummab,为患者提供了深层次的缓解,并在长期保持稳定。对于65岁以下并具备移植条件的患者,经过4个标准化疗方案后,自体干细胞移植的巩固治疗能够有效地帮助患者实现长期缓解状态。
病例介绍
2019年2月,一名40岁的男性患者在常规体检中发现肌酐升高及尿蛋白+++,随后前往医院就诊。影像学检查显示浆细胞比例为20%,免疫固定电泳提示M蛋白含量为16.9%,IgA水平为10.3g/L,κ链为13.6g/L,游离κ-轻链为2510.00mg/L,Fκ-/Fλ-轻链比值为241.346。活检结果显示浆细胞增生,分布弥散或小灶,刚果红染色结果为阴性(见图1)。FISH探针检测显示1q21位点扩增和IGH重排可能(见图2)。染色体核型正常。诊断为多发性瘤(IgA-κ型,ISS分期Ⅱ期,DS分期Ⅰ期A亚型),属于高危组。治疗方案为两个疗程“PCD”(硼替佐米2.3mg[d1,4,8,11]+地塞米松40mg[d1-2,4-5,8-9,11-12]+环磷酰胺500mg[d1,8,15])短疗程化疗。复查M蛋白结果为14.2%,随后进行了两个疗程的“VRd”治疗(硼替佐米2.3mg[d1,4,8,11]+来那度胺25mg[d1-d14]+地塞米松20mg[d1-2,4-5,8-9,11-12])。复查结果显示M蛋白为8.2%,影像学检查大致正常,未见浆细胞。2019年7月12日,患者接受了环磷酰胺3.0g和依托泊苷0.4g联合化疗以进行动员,7月20日注射细胞因子G-CSF 150ug,[1/12h*4]动员,7月24日至26日进行分离和冻存造血干细胞,总分离细胞数为MNC464.4*10^8个,平均每公斤7.5*10^8个,CD34+细胞数为8.82*10^6。预处理采用马法兰,过程顺利。8月2日完成自体干细胞移植,回输自体干细胞201ml,活化细胞比例为90%,输注过程顺利。术后第4天患者出现口腔溃疡、恶心、呕吐等症状,给予细胞因子、TPO等治疗,并进行预防性抗真菌、抗感染、抗病毒及止血治疗,同时支持输注血小板。第12天,患者的粒细胞和血小板植活。9月11日复查免疫固定电泳结果显示M蛋白为24.7%,ELP上出现一条M蛋白带,与抗IgG和抗K形成的特异性反应沉淀带略有异常。9月20日给予单药硼替佐米2.3mg[d1,4,8,11]维持治疗,复查结果显示M蛋白转阴,影像学检查正常,微小残留阴性(见图3)。
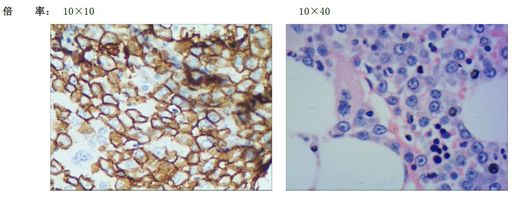
图1.活检:刚果红染色结果为阴性
免疫组化显示CD38:弥散或小灶性阳性;CD138:弥散或灶性阳性(见图);CD56:弥散或小灶性阳性;Ka:散在或灶性阳性;Lambda:个别细胞阳性,结论为异常浆细胞增生,考虑浆细胞性瘤(PCM)。
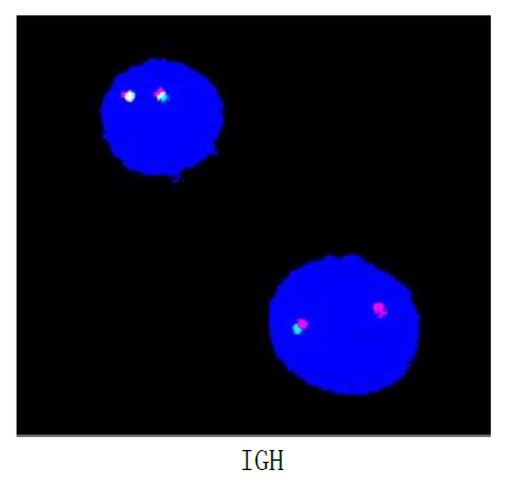
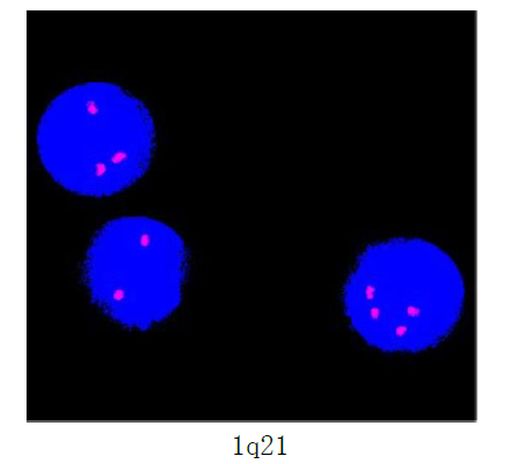
图2. FISH探针结果:1. IGH分离探针表现为非典型异常信号模式,阳性率约为28%;2. 1q21位点信号扩增,阳性率约为43%。
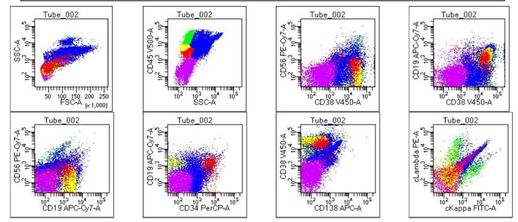
图3. 微小残留检测:未见免疫表型明显异常的细胞(残留瘤细胞<10^-5)。
讨论
在自体干细胞移植后,患者的免疫固定电泳显示M蛋白为24.7%,并出现了新的M蛋白带(见图4),这一现象是否意味着疾病复发呢?
自体干细胞移植后的监测中,我们常见恶性浆细胞克隆产生的单克隆重链和/或轻链,这在血清蛋白电泳中表现为M尖峰,作为疾病的重要标志物。监测M蛋白的水平是临床评估多发性瘤的常用指标。研究表明,经过大剂量化疗后的自体干细胞移植,部分患者可能出现寡克隆免疫球蛋白条带(与初诊时鉴定的免疫球蛋白不同,这种现象被称为克隆同种型转换(CIS))。尽管CIS与临床预后和免疫重建的关系尚不明确,但在Ye Rebecca的回顾性分析中,有22%的MM患者在自体干细胞移植后出现了CIS。CIS与无进展生存期和总生存期相关联,且复发患者的同种型通常与CIS不同。CIS还与较低的CD8+ T细胞百分比和较高的CD4/CD8比值相关联。CIS被认为是一种良性的现象,可能预示着患者获得长期缓解,且可能与B细胞之外的免疫系统有关,具体机制仍需进一步研究。

